Quella che identifichiamo solitamente come acidità di stomaco (no, non è colpa delle fragole con la panna o degli spaghetti con le polpette), contrariamente a quanto si crede, non è causata direttamente dallo stomaco (che solo raramente produce un eccesso di acido cloridrico).
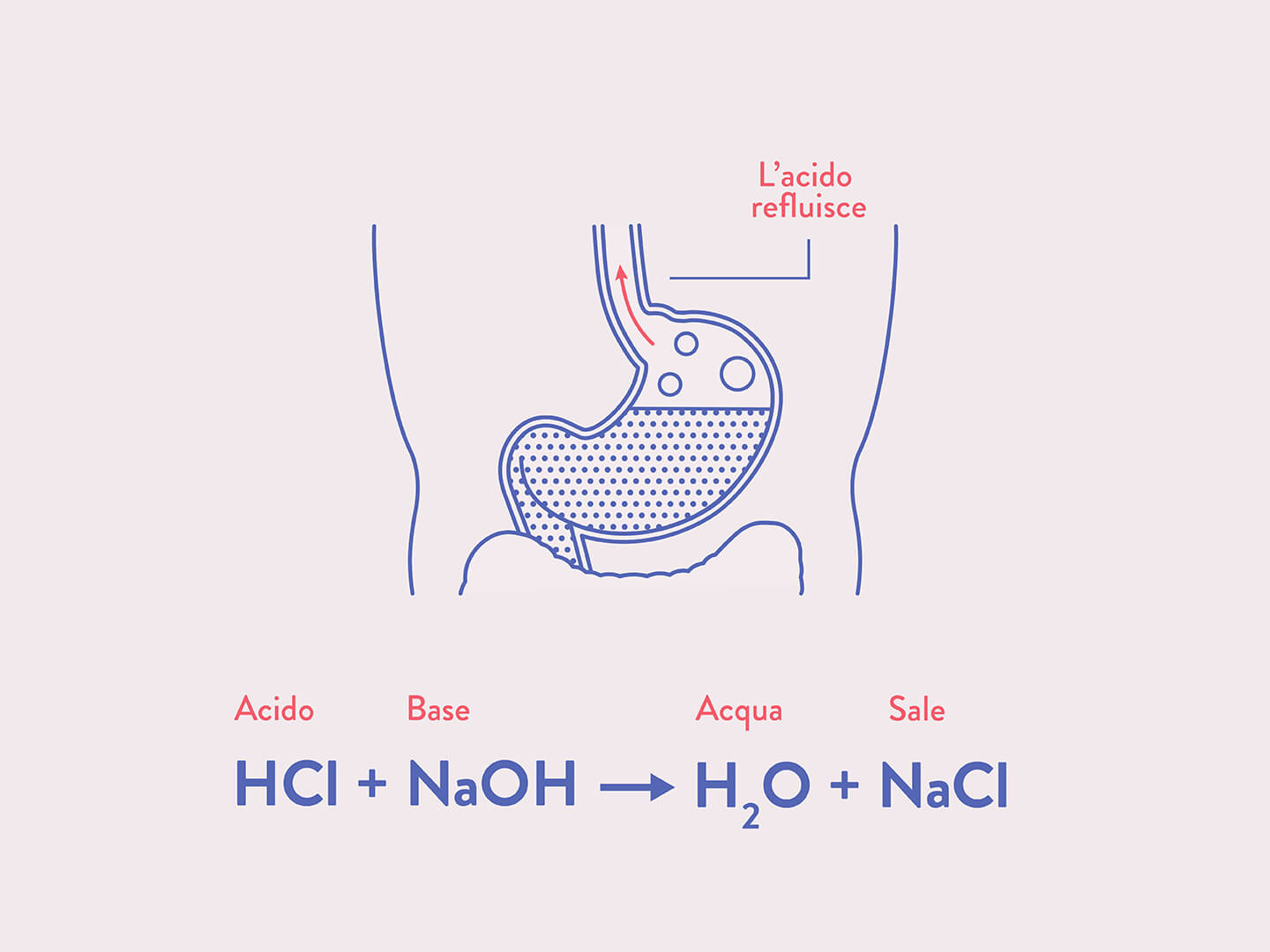
Il tipico bruciore di stomaco è dovuto al fatto che l’acido prodotto, invece di mescolarsi con il cibo, refluisce all’indietro nell’esofago.
Le mucose dello stomaco sono perfettamente in grado di difendersi dall’attacco del succo gastrico (e quindi non possono produrre bruciore). Al contrario le mucose dell’esofago non sono protette ed è proprio lì che si genera il tipico bruciore.
Piccoli reflussi postprandiali sono assolutamente normali e non provocano problemi. Tuttavia se il reflusso è abbondante e avviene con una certa frequenza (2-3 volte alla settimana) si tratta di una vera e propria patologia (malattia da reflusso gastro-esofageo) e per curarla è assolutamente necessario rivolgersi a medici specialisti. In assenza di patologie, per evitare i reflussi occasionali, è bene seguire norme comportamentali legate al buon senso, prima fra tutte non esagerare con cibi e bevande. Comunque, se proprio non riuscite a controllarvi, qualche farmaco antiacido può venire in vostro aiuto.
Per comprenderne il funzionamento dobbiamo prima approfondire il discorso su acidi e basi.
Nel linguaggio quotidiano, qualsiasi sostanza irritante e/o corrosiva viene chiamata acido: ma questo non sempre corrisponde al vero. In chimica il termine “acido” ha infatti un suo significato preciso. Oltre agli acidi ci sono poi le basi (o alcali), che hanno un comportamento chimicamente opposto e reagiscono con i primi per originare i sali (reazione di neutralizzazione).
- Un primo tentativo di definire esattamente gli acidi e le basi venne proposto nel 1884 dal chimico svedese Svante August Arrhenius (1859-1927), premio Nobel nel 1903. Secondo Arrhenius, un acido è una sostanza che in acqua cede ioni idrogeno positivi H+ (protoni o idrogenioni). Viceversa una base è una sostanza che cede ioni negativi formati da un atomo di ossigeno legato a uno di idrogeno: OH- (ossidrili o ossidrilioni). La definizione di Arrhenius è “assoluta”: non considera cioè l’eventualità che una stessa sostanza, a seconda del partner chimico con cui interagisce, possa comportarsi indifferentemente da acido o da base.
- Per tenere conto di questi aspetti, nel 1923, il danese Johannes Nicolaus Brønsted (1879-1947) e l’inglese Thomas Martin Lowry (1874-1936) proposero una nuova definizione. Un acido è una specie in grado di cedere ioni H+ e una base è una specie in grado di acquistarli. Questo presuppone che acidi e basi agiscano sempre in coppia e che una reazione acido-base sia dovuta semplicemente a uno scambio di protoni. Naturalmente la specie che ha perso ioni H+ è potenzialmente in grado di riacquistarli e, viceversa, la specie che li ha acquistati è in grado di cederli. Per questo motivo, nella teoria di Brønsted e Lowry, si parla di coppie coniugate acido-base.
- Nello stesso anno l’americano Gilbert Newton Lewis propose una teoria ancora più generale, secondo la quale un acido è una specie in grado di accettare un doppietto elettronico (coppia di elettroni sullo stesso orbitale con spin opposti) mentre una base è in grado di cederlo. La teoria di Lewis estende dunque i concetti di acidità e basicità anche a sostanze che non necessariamente contengono idrogeno.
Per misurare il grado di acidità o basicità di una soluzione, si definisce la grandezza chiamata pH. Particolari soluzioni hanno la caratteristica di mantenere pressoché costante il loro pH, anche in seguito all’aggiunta di acidi o di basi: le soluzioni tampone (come il nostro sangue ad esempio).

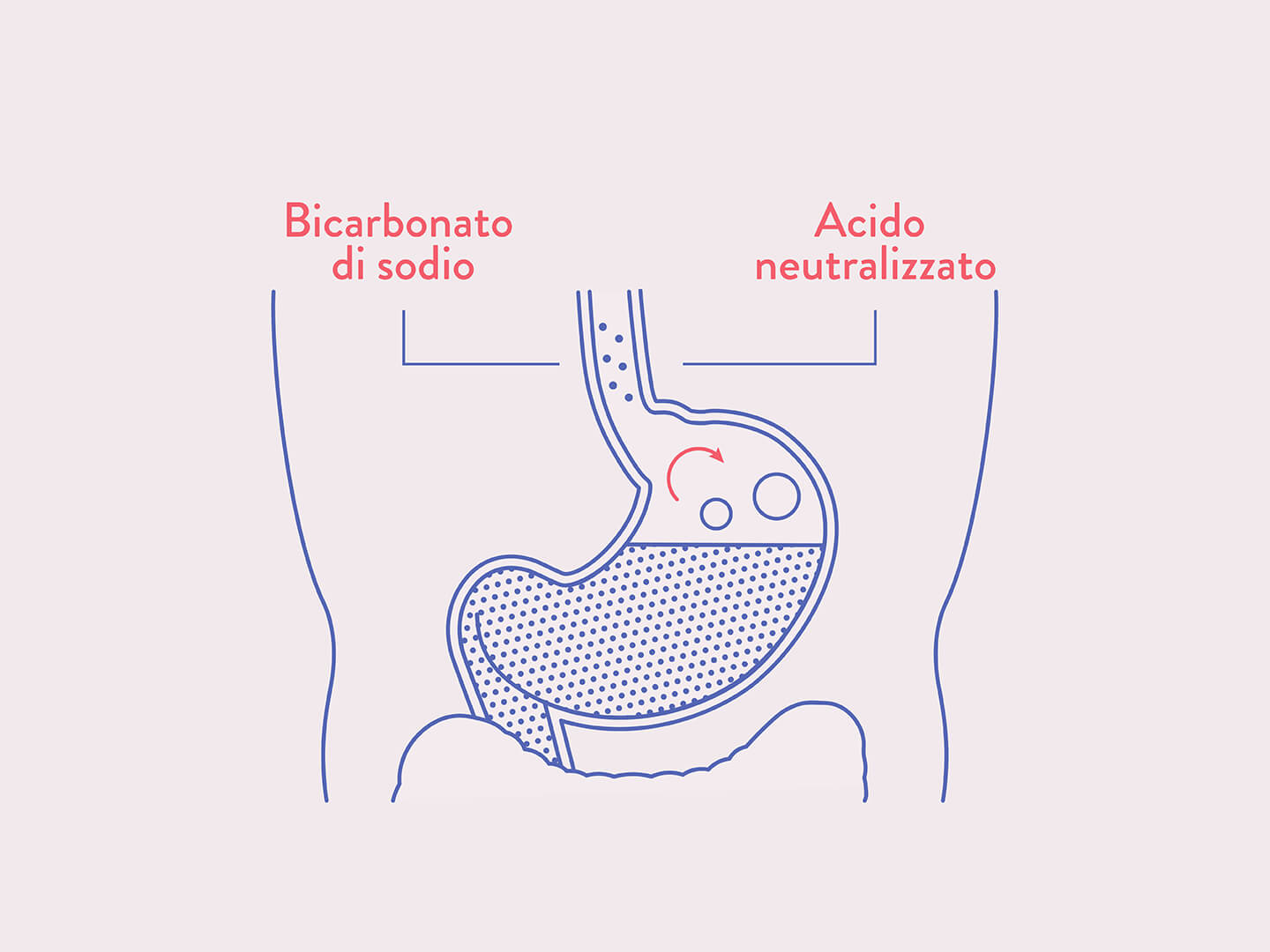
Tornando all’acidità di stomaco (o meglio di esofago), essa può essere combattuta in due modi. Esiste una via strategica che consiste nell’utilizzare farmaci antisecretivi che limitano la produzione di acido cloridrico.
Più comunemente però viene utilizzata una via tattica utilizzando farmaci antiacidi. I farmaci antiacidi sono prodotti che contengono sostanze basiche, in grado di neutralizzare l’eccesso di acido. Il più antico e conosciuto è il bicarbonato di sodio. Esso non è propriamente una base, nel senso di un idrossido, bensì un sale; tuttavia, derivando da una base forte (l’idrossido di sodio) e un acido debole (l’acido carbonico) può presentare un comportamento basico e reagire con un acido neutralizzandone l’effetto.
Esistono molti antiacidi in commercio: sono a base di magaldrato o alluminato di magnesio monoidrato, di idrossido di magnesio o idrossido di alluminio. Oltre a non apportare sodio, questi prodotti hanno il vantaggio di poter legare i sali biliari eventualmente presenti (per reflusso prima duodeno-gastrico e poi gastro-esofageo) ed essere quindi utili anche nei casi di reflusso cosiddetto alcalino, che può verificarsi in alcune patologie.
Per i contenuti si ringrazia Silvano Fuso, divulgatore e autore del libro “Chimica quotidiana. Ventiquattro ore nella vita di un uomo qualunque”.