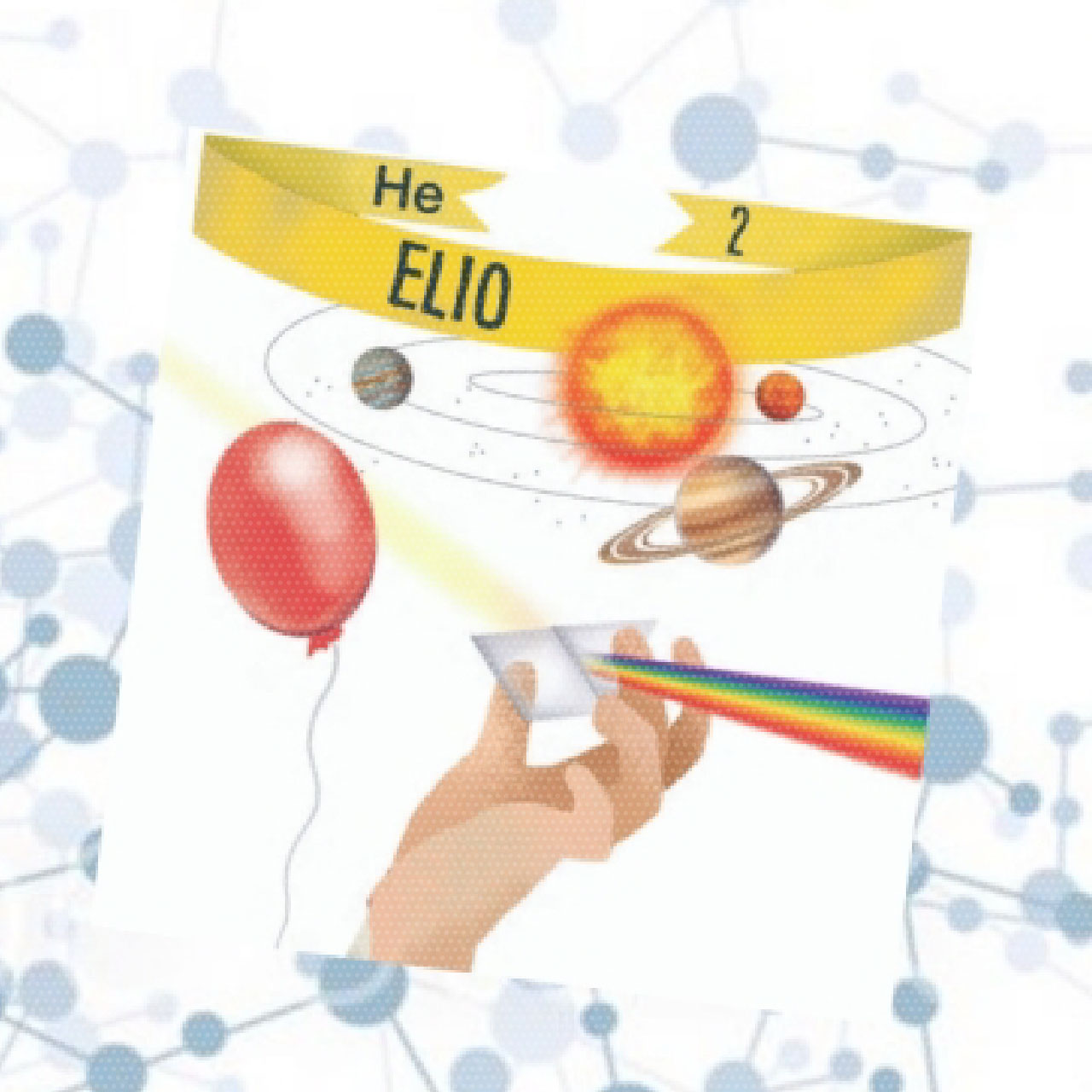
Fu proprio allora che notò una riga gialla e brillante nello spettro della cromosfera solare corrispondente ad una lunghezza d’onda fino ad allora sconosciuta, rilevando tracce di un elemento che non aveva una controparte sulla Terra: l’elio.
Gli elementi chimici infatti si rivelano tramite successioni univoche di bande chiare e bande scure lungo lo spettro. Con meraviglia e stupore l’astronomo si accorse che le caratteristiche chimiche distintive del Sole non erano identiche a quelle ottenute in laboratorio: il prisma mostrava che sia la Terra che il Sole contengono idrogeno, carbonio, ossigeno, azoto, calcio, ferro, ma non l’elio, presente invece solo sul Sole.
L’elio (dal nome greco del Sole, helios), dunque, è stato il primo elemento della tavola periodica a essere stato scoperto in un posto diverso dalla Terra.
Sul nostro pianeta, l’elio si trova solo “intrappolato” in preziosi e sempre più rari giacimenti sotterranei. Infatti quello che poteva stare in atmosfera è stato perduto nelle fasi iniziali di formazione della terra.
E’ il secondo elemento più abbondante dell’universo e il più leggero dopo l’idrogeno.
Viene principalmente usato nei laboratori di tutto il mondo per la gascromatografia (ovvero il metodo di separazione dei composti allo stato di gas o di vapore). Un altro importante impiego è come refrigerante (allo stato liquido è a -269°C) per i magneti delle apparecchiature ospedaliere per diagnostica NMR (risonanza magnetica nucleare). Viene utilizzato inoltre per gonfiare dirigibili, palloni aerostatici, palloncini giocattolo e, essendo un gas inerte, lo troviamo presente anche nelle bombole per le immersioni e nei sommergibili, in miscela con l’ossigeno.
Fonti: Astrofisica per chi va di fretta di Neil deGrasse Tyson
www.tavolaperiodica.unicam.it
Scopri di più su mendeleevatavola.federchimica.it