Anche in questo caso la chimica è una valida alleata: cominciamo dal sugo. Prendiamo le cipolle, sbucciamole e tagliamole molto sottili…(come dicono gli chef, “alla julienne”) e qui iniziano i dolori, o meglio, le lacrime! Vi siete mai chiesti come mai?
Le proprietà lacrimogene delle cipolle sono ben note, ma pochi sanno da cosa derivino. La cipolla (Allium cepa) è una pianta bulbosa, appartenente al genere botanico Allium. Allo stesso genere appartengono anche altre varietà ben più conosciute in cucina quali l’aglio, il porro e lo scalogno.
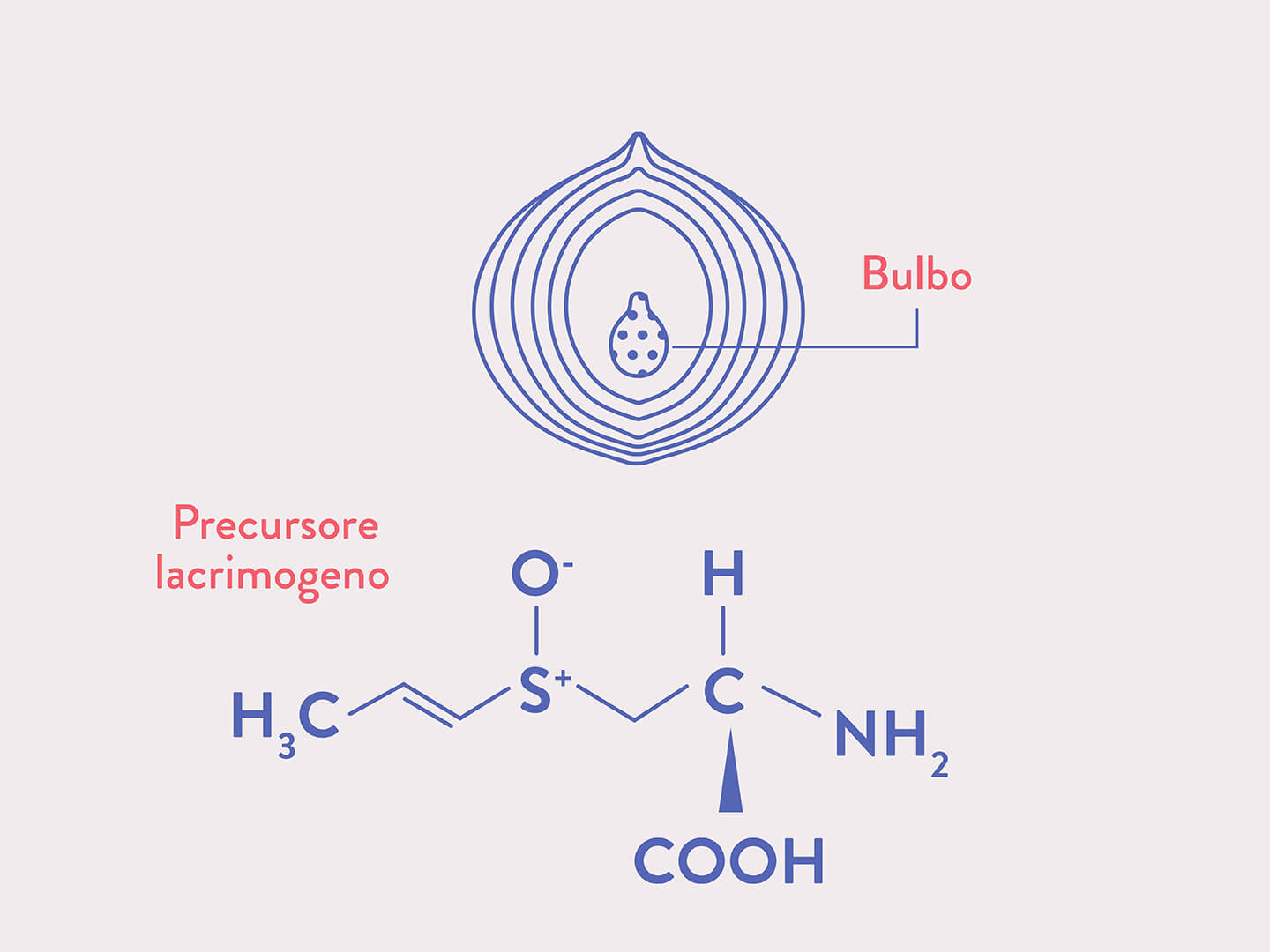
Le proprietà lacrimogene delle cipolle derivano da composti volatili che si generano nel momento in cui i bulbi vengono tagliati. Nelle cellule del bulbo è presente un particolare composto (S-1-propenil-L-cisteina solfossido) nella cui molecola compare un radicale allile, un gruppo solfossido (S=O) e un amminoacido (cisteina). Nel momento in cui si affetta la cipolla e si rompono le pareti cellulari, un particolare enzima (allinasi) idrolizza questo composto e porta alla formazione dell’acido propenil-sulfenico (CH,-CH,-CH,-S-OH). Un secondo enzima (LF-sintasi: LF sta per Lacrimathory Factor) trasforma l’acido propenil-sulfenico in propantialsolfossido. È proprio il propantialsolfossido, estremamente volatile, il vero agente irritante per gli occhi: quando entra in contatto con l’umore acquoso presente sulla cornea, reagisce con l’acqua liberando acido solforico. Come reazione di difesa, l’occhio aumenta la produzione di lacrime.
Tuttavia la maggiore lacrimazione non fa che trasformare una maggior quantità di propantialsolfossido in acido solforico, generando ancora maggior bruciore in una beffarda – quanto fastidiosa – reazione a catena. L’acido solforico prodotto è molto diluito e, bruciore a parte, non provoca danni all’occhio. Il propantialsolfossido è molto solubile in acqua. È una reazione di difesa: l’occhio aumenta la produzione di lacrime.
Di conseguenza, se si affettano le cipolle sotto l’acqua corrente, il principio lacrimogeno scompare (è però piuttosto difficile affettare sottilmente le cipolle sotto l’acqua corrente!).
Conclusa la penosa affettatura delle cipolle, prendete un padella, versate le cipolle e iniziate a soffriggerle (se volete potete aggiungete un pizzico di bicarbonato di sodio, per facilitare la reazione di Maillard). Dopo pochi minuti, il soffritto ha assunto una consistenza cremosa, un colore dorato e un sapore decisamente buono!
A questo punto, se non avete abbastanza tempo per preparare la salsa, versate in padella una passata di pomodoro pronta.
La polpa di pomodoro contiene numerosissimi composti. Il sapore acido è dovuto alla presenza di acidi carbossilici, soprattutto acido citrico e acido malico. C’è anche un’elevata quantità di vitamina C che però, essendo termolabile, non ritroverete nella vostra salsa. Sono inoltre presenti le vitamine del gruppo B (B1, B2 e B6) e provitamina A sotto forma di beta-carotene, uno dei componenti che conferiscono al pomodoro il suo colore rosso.
I pomodori contengono poi molti polifenoli, che esercitano diverse funzioni benefiche e protettive sull’organismo. Oltre al Beta-carotene, la polpa di pomodoro contiene diverse altre molecole con struttura molecolare simile, chiamati perciò carotenoidi. Tra questi quello più presente nei pomodori è il licopene, principale responsabile della sua colorazione rossa. Il licopene è un idrocarburo alifatico insaturo che ha molte proprietà benefiche.
Le sue proprietà antiossidanti determinano un’azione protettiva nei confronti dei tumori (ad esempio quello alla prostata), un effetto cardioprotettivo e fotoprotettivo nei confronti dei danni provocati dai raggi UV. Esercita inoltre un’attività anti-neurodegenerativa e preventiva nei confronti dell’osteoporosi. Molto spesso si pensa che la cottura dei cibi faccia perdere molte delle loro proprietà nutrizionali. Se questo è vero per alcune sostanze (ad esempio la citata vitamina C), non è affatto vero per altre.
Nel caso del licopene, la cottura può aumentarne la biodisponibilità. È stato provato che temperature elevate tra i 90 e 150 °C possono effettivamente diminuire il contenuto totale di licopene. Se la temperatura rimane però inferiore ai 100 °C, la degradazione è modesta.

È il momento di buttare la pasta! La cottura della pasta non è un processo banale dal punto di vista chimico. Innanzitutto, appena buttiamo la pasta osserviamo una momentanea interruzione dell’ebollizione. Questo accade perché la pasta, inizialmente a temperatura ambiente, deve scaldarsi e, assorbendo calore, fa diminuire momentaneamente la temperatura dell’acqua.
Ma come si fa la pasta? La farina di grano duro usata per preparare la pasta contiene amido e proteine. La concentrazione delle proteine, in particolare globuline e prolammine, è importante per l’ottenimento del prodotto finale. Quando alla farina viene aggiunta l’acqua per ottenere l’impasto, le prolammine danno origine al glutine.
La lavorazione meccanica effettuata durante l’impasto provoca una distensione delle proteine del glutine che formano filamenti tenuti assieme da legami a idrogeno e ponti di solfuro. In tal modo il glutine assume una struttura ordinata, in grado di inglobare granuli di amido e bolle d’aria. All’interno del granulo vi sono zone amorfe e zone cristalline. Le porzioni amorfe sono costituite prevalentemente da amilosio (polimero lineare del glucosio) e in parte da catene di amilopectina (polimero ramificato del glucosio). Le zone cristalline sono invece costituite dalle catene dell’amilopectina, ordinate in direzione centro-periferia. La struttura complessiva del granulo comprende una successione alternata di regioni amorfe e regioni cristalline concentriche.

Torniamo alla nostra pasta in pentola: durante la cottura, l’acqua calda produce una gelatinizzazione dell’amido, ovvero una progressiva disorganizzazione della forma cristallina, verso uno stato di gel. La gelatinizzazione dell’amido procede dall’esterno del prodotto, il quale progressivamente rigonfia. La penetrazione dell’acqua all’interno dei granuli avviene per osmosi.
L’elevata temperatura e il movimento che la pasta subisce per effetto dell’ebollizione facilitano il processo. In una cottura corretta la pasta deve rimanere ‘al dente’, ovvero deve essere cotta in modo uniforme (e non cruda al centro!).
Buona cena!
Per i contenuti si ringrazia Silvano Fuso, divulgatore e autore del libro “Chimica quotidiana. Ventiquattro ore nella vita di un uomo qualunque”.















