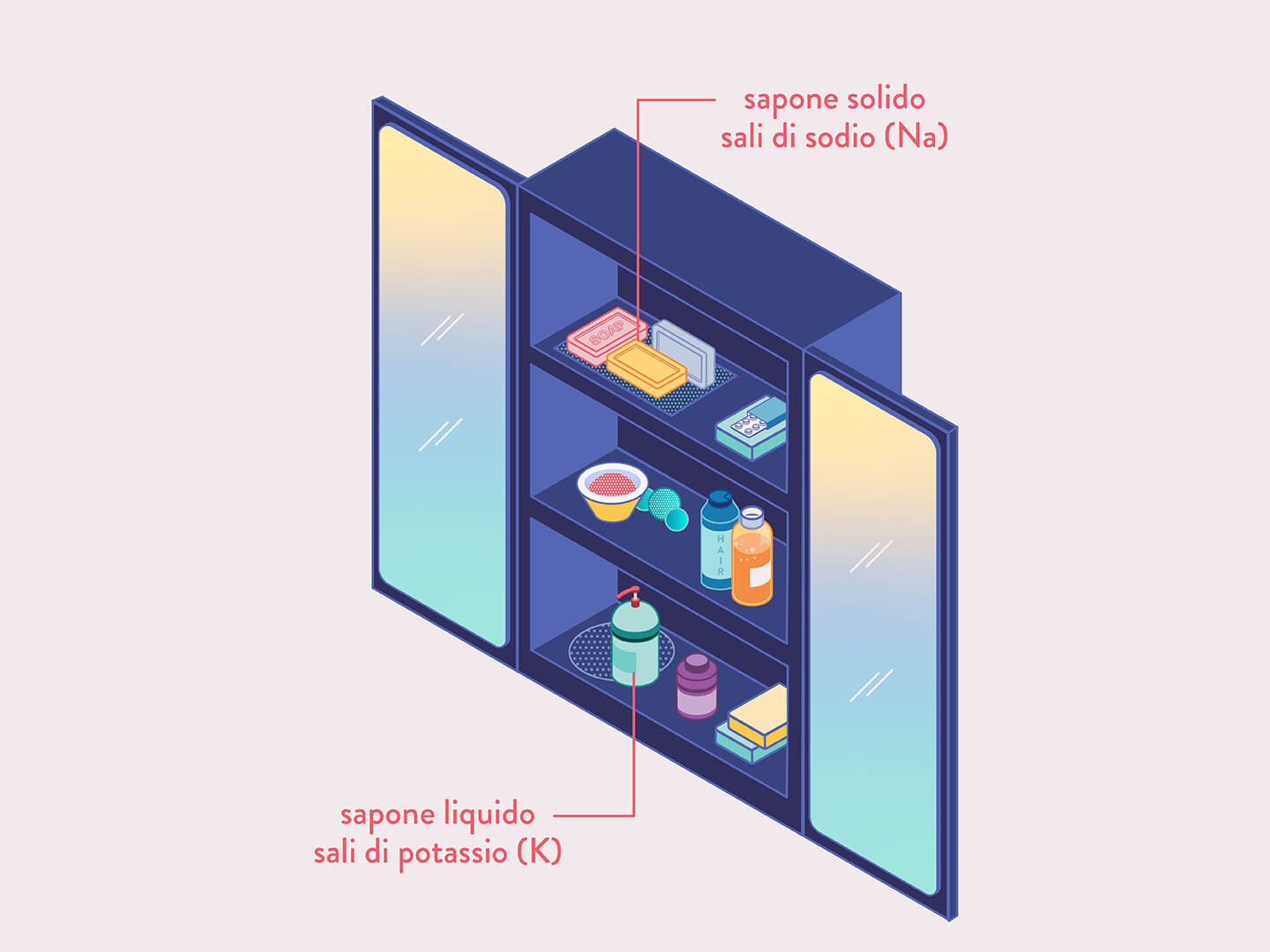
Cominciamo dal sapone. Con il termine “sapone” si indicano i sali di sodio (Na) o di potassio (K) di acidi carbossilici a lunga catena. I saponi di sodio sono generalmente solidi, mentre quelli di potassio sono liquidi. Tra gli acidi carbossilici comunemente presenti nei saponi ricordiamo l’acido laurico, il miristico, il palmitico, lo stearico, l’oleico, il linoleico e il linolenico.
Come possiamo facilmente intuire da alcuni dei loro nomi, questi acidi si trovano in diversi vegetali: alloro, palma, olive, semi di lino ecc. In particolare si trovano sotto forma di gliceridi. Questi ultimi sono molecole (appartenenti alla categoria dei grassi o lipidi) che derivano dalla combinazione degli acidi carbossilici con la glicerina (o glicerolo). La glicerina è un alcol trivalente, ovvero una molecola costituita da tre atomi di carbonio (legati a diversi atomi di idrogeno) che presentano ciascuno un gruppo ossidrile. Ognuno di questi gruppi può combinarsi con il gruppo carbossilico dell’acido attraverso un particolare legame chiamato “estereo”. Se viene esterificato un solo ossidrile si parla di monogliceridi, se ne vengono esterificati due si formano i digliceridi, se, infine, sono esterificati tutti e tre abbiamo i trigliceridi.
Oltre che nei vegetali citati, i gliceridi si trovano anche nei grassi di origine animale (burro, strutto). Per ottenere un sapone si può pertanto partire da un grasso e trattarlo, a caldo, con idrossido di sodio (soda caustica) o di potassio (potassa caustica). Durante la reazione di saponificazione, si formano i Sali sodici o potassici degli acidi carbossilici, cioè i saponi, e si ottiene come sottoprodotto la glicerina.
Per comprendere le proprietà detergenti dei saponi occorre considerare la loro struttura molecolare. Le lunghe catene di atomi di carbonio e idrogeno degli acidi carbossilici hanno quello che i chimici chiamano un carattere “idrofobico”, che significa letteralmente “che ha paura dell’acqua” e indica la scarsissima affinità che queste catene hanno nei confronti dell’acqua, nella quale sono pertanto insolubili. Queste catene hanno invece affinità per i grassi, sono cioè lipofile.
Per contro il gruppo carbossilico salificato da ioni metallici ha un carattere idrofilo, cioè ha molta affinità nei confronti dell’acqua. Questo deriva dalla presenza di una carica elettrica negativa che può interagire con le molecole d’acqua, che presentano a loro volta una parziale separazione di carica elettrica (i chimici affermano che sono molecole polari). Le molecole del sapone in acqua tendono ad aggregarsi tra loro in piccole sferette al cui interno si concentrano le catene idrofobe.
Sulla superficie delle sferette (dette micelle), invece, si distribuiscono le teste idrofile, costituite dai gruppi carbossilati carichi negativamente. La superficie idrofila consente loro di disperdersi nell’acqua creando una sospensione. Se sono però presenti sostanze grasse (come generalmente accade nello sporco), esse vengono inglobate all’interno delle micelle tra le catene lipofile. In tal modo lo sporco può disperdersi in acqua e può essere pertanto allontanato.
Quando ci si fa la doccia, o in maniera ancora più evidente quando ci si fa il bagno nella vasca, può capitare di vedere sul fondo dei depositi grigiastri che fanno pensare, con una certa meraviglia, di essere stati davvero molto sporchi. In realtà non dipendono da noi, ma spesso derivano dalla presenza di sali di calcio o di magnesio nell’acqua utilizzata. La presenza di questi sali determina ciò che i chimici chiamano durezza di un’acqua. Una durezza elevata può spesso rendere sgradevole il sapore dell’acqua e può creare problemi di incrostazione (il calcare). Gli ioni di calcio e magnesio presenti nell’acqua possono inoltre reagire con il sapone prendendo il posto degli ioni sodio e potassio. Mentre i saponi di sodio e potassio sono solubili, quelli di calcio e magnesio sono al contrario insolubili e sono responsabili degli inquietanti depositi grigiastri che osserviamo talvolta sul fondo della vasca.
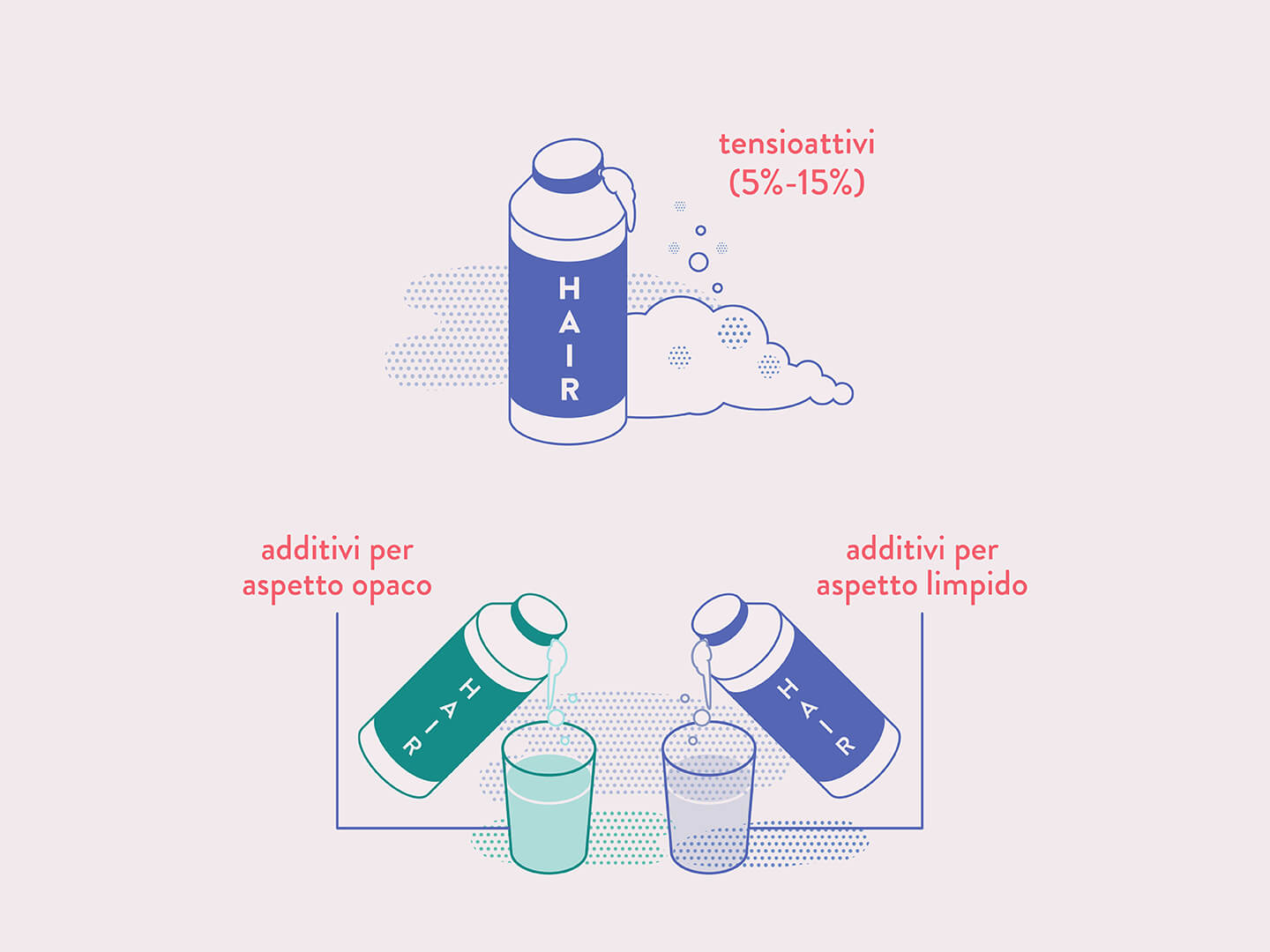
Le proprietà dei saponi di formare micelle è comune agli altri detergenti. Tutte le sostanze che presentano queste caratteristiche sono chiamate tensioattivi (o surfattanti, dall’inglese surface-active agents) perché hanno la proprietà di abbassare la cosiddetta tensione superficiale dell’acqua.